
如果實(shí)驗(yàn)設計不(bú)嚴謹——以漸凍人(rén)症轉基因小鼠藥物研發為例
肌(jī)萎縮性脊髓側索(suǒ)硬化症

因中(zhōng)樞神經係統內控(kòng)製骨(gǔ)骼肌運動的神經元退化導致的肌萎縮性脊(jǐ)髓側索硬化症(Amyotrophic lateral sclerosis: ALS,也稱漸凍人症)是一種(zhǒng)漸進且致命的神經退行性疾病。由於運動神經(jīng)元(yuán)退化和死亡,肌肉逐漸萎縮致大腦完全喪失(shī)控製隨意運動的能力,最終會造成(chéng)發音、吞咽,以及呼吸和運動(dòng)障礙。著名物理(lǐ)學家霍金(jīn)就是(shì)一(yī)名ALS患者。目前還沒有真正可有效治療ALS的藥物和方法。
絕大多數(90-95%)的ALS發病原因不明,但也(yě)有(yǒu)約5-10%的ALS患者表現出了家族遺傳性,其中超氧化物歧化(huà)酶 1(Superoxide Dismutase 1:SOD1)基因突變約占這些遺傳性ALS病例的(de)10%。SOD1也是第一個被鑒定出(chū)來的ALS風險基因[1],因此很快就有科學(xué)家構建了一種含有第93位甘氨酸突變為丙氨酸(suān)(G93A)的人SOD1基因的轉基因小鼠模型(xíng),全名為B6SJL-Tg(SOD1*G93A)1Gur/J轉基(jī)因小鼠[2]。該轉基因小鼠(shǔ)基因組中被轉入了23個拷貝的人源SOD1*G93A突變基因,接下來我們將其簡稱SOD1*G93A轉基因小鼠。

圖二:SOD1*G93A轉基(jī)因小鼠是以B6和SJL雜交子代為背景品係,通(tōng)過原核注射和胚胎移植得到(dào)的轉基因小鼠模型,因此其毛(máo)色多樣,圖片來自Jax實驗(yàn)室(https://www.jax.org/strain/002726)
自1996年SOD1*G93A轉基因小鼠問(wèn)世以後,其就(jiù)被廣泛應用於ALS藥物研發的臨床前動物試驗中。到2004年,短短8年時(shí)間內,已至少有50篇文章描述了從小分子(zǐ)到病毒載體的各類ALS治療方案,可延長SOD1*G93A轉基因小鼠的壽命,其中最長(zhǎng)可(kě)以延長壽命100天(78%的壽命延長)。這些藥物很快進入臨(lín)床試驗,然(rán)而,迄(qì)今為(wéi)止(zhǐ),除(chú)了利魯唑(zuò)(最多延長ALS患者兩個月壽命)之外,沒有任何一種藥(yào)物顯(xiǎn)示出對人類ALS疾病的進程有顯著影響[3]。這給醫藥公司帶來了巨大損失,如2008年在美國國家科學院院刊上發(fā)表的一篇文章(zhāng)顯示鋰可(kě)以(yǐ)將SOD1*G93A轉基因小鼠的存活時間延長30天[4]。由於鋰早已經被用於治療精神分裂症(zhèng),許多ALS患者開始超說明書服(fú)用該藥物,希望減緩疾病進(jìn)程。然而,招募了數百名(míng)患者,花費(fèi)了遠超1億美元(yuán)的三個同時啟動的獨立III期臨(lín)床試驗結果卻顯示鋰對ALS無任何治療效果。
其實(shí)不(bú)僅僅是ALS的藥(yào)物研發,在整個醫藥研發領域,動物實驗結果的平均臨(lín)床轉化率也是非常低的,平均在11%左右 。那麽(me)到底(dǐ)是(shì)什麽原因導致了(le)如此高比例的(de)動物實驗(yàn)結果無法實現在人類的臨床轉化呢?
1999年,美國麻(má)省理工學院的(de)機械工程師詹姆斯·海伍德在得知(zhī)他的哥(gē)哥(gē)史蒂芬·海伍德被確(què)診患有ALS,並無任何有效治(zhì)療方法後,與家人一起創立(lì)了一家非(fēi)盈利性生物技術公司,即ALS 治療開發(fā)研究(jiū)所 (ALS-TDI)。ALS-TDI成立後開展了(le)一項旨在尋找SOD1*G93A轉基因小鼠實驗結果臨床轉化失敗原因(yīn)的項目(mù),即使(shǐ)用SOD1*G93A轉基因小鼠重複已發表科研論文中的動物實驗,以找出其臨(lín)床轉化失敗的(de)原因。
在ALS-TDI開展的重複性實驗中,他們不僅嚴格執行盲法對照,而且對給藥組和對照組的動物進行(háng)了更為精細的分配和動物篩查以排除係統誤差。他(tā)們分組及實驗要求包括:
⑴ 年齡匹配(pèi);
⑵ 性別匹配;
⑶ 同窩匹配:即使用同一天出(chū)生的同一非轉基因母親和轉基(jī)因父親的後代進行分組,具體來說,治療組中的每個雄性(和雌性)在對照組中都有一個同窩兄弟(和姐妹);
⑷ 樣本量設定(dìng):每組使用動物數量為(wéi)24隻(12雌,12雄);
⑸ 死因(yīn)篩查(chá):檢查記錄每(měi)一(yī)隻動物的死亡(wáng)原因,排出非ALS致死個體;
⑹ 轉基因拷貝數監控:有(yǒu)研究證明SOD1*G93A轉基因小鼠在傳代過程中會出現轉基因拷貝數丟失的現象,且低拷貝的轉基(jī)因小鼠的平均(jun1)壽命會加長。
在這一嚴格實驗分組和動物篩查條件下,ALS-TDI的科研人員總共使用了5429隻(zhī)SOD1*G93A轉基因小鼠測試了包括(kuò)利魯唑在內的100多種(zhǒng)(大部分已有論(lùn)文發表並證明可(kě)延長SOD1*G93A轉基因小鼠壽命)候選化合物,卻沒有發現任一化合物表現出可延長SOD1*G93A轉基因小鼠(shǔ)壽命(mìng)的效果(圖三)。
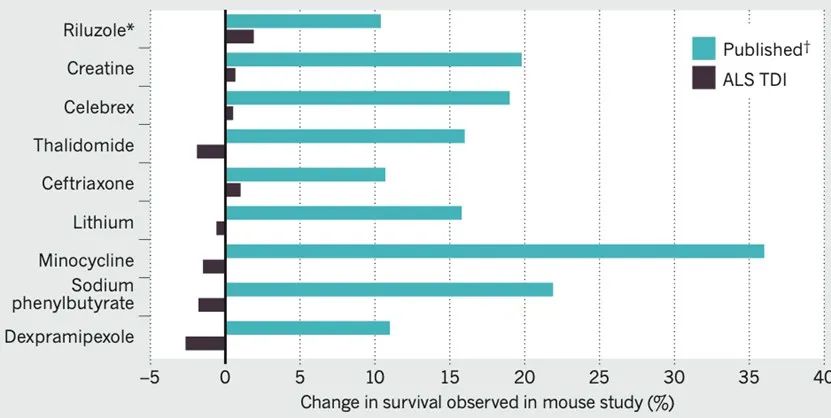
圖三:ALS-TDI以SOD1*G93A轉基因小鼠開展的重複實驗結果與已(yǐ)發表實驗結果對比[3]
為找出導致那些已經發表實驗結果無法(fǎ)被(bèi)重複的原因,他(tā)們以在ALS-TDI開展實驗中所使用的2000多隻對照小鼠作為研究對象,進行了(le)計算機分組模擬實驗。由(yóu)於(yú)這些小鼠從出生到死亡及死亡原因的信息在ALS-TDI都有詳細的記錄,因此他們能夠以所(suǒ)有對照小鼠為數據庫,分析(xī)前述重複實驗中設定的(de)不同(tóng)分組和動物篩查條件對實驗結果(guǒ)的影響。即通過計算機對這些沒有經過任何藥物處理的小鼠進行分組,將一組設為假定的實(shí)驗(yàn)組,而另一組設為假定(dìng)的對照(zhào)組,然後依據(jù)已有的(de)小鼠死亡(wáng)時間記錄,統計兩(liǎng)組(zǔ)小鼠之間是否存在顯著差異。經過(guò)多次重複,計算(suàn)出現5%以上顯著差(chà)異的百分比。由於這些對照小鼠沒有接受過任何化合物(wù)處理,因此如果假(jiǎ)定的實驗組和對照組中出現了顯著(zhe)性差(chà)異,那麽其(qí)來源應該是分(fèn)組時的係統(tǒng)誤差。
結果顯示,在樣本量大小(xiǎo)為4的計算機分組模擬對比實驗中,在隨機分組(zǔ)和不進行死因篩查(chá)及排除(chú)低轉基因拷貝數個體條件(jiàn)下(xià),兩組間出現顯著差異的可能性(xìng)超過了50%。而隨機(jī)分(fèn)組(zǔ)的同時(shí)進行(háng)死因(yīn)篩查並排除低轉基因拷貝(bèi)數個體和進行性別匹配的分組條件(jiàn)下,樣本量為4的模擬分組實驗中也有30%的可能出現兩組死亡時間的顯著差異(圖四)。隨著樣本量(liàng)的增加(jiā),出現顯著性差異的可(kě)能(néng)性逐漸減少,但要實現低於5%(統計學上通常設置的顯著置信區間)的顯著性差異,樣本量要達(dá)到每組24隻動物。如(rú)果不做分組(zǔ)條件控製,即使樣本量到50隻也難以排除係統誤差。
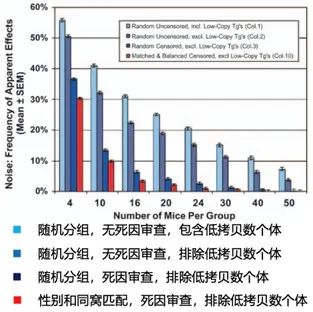
圖四:分組條件導致的係統誤差[3]
ALS- TDI的這個計算機模擬實驗結果說明,前述那些已經發表的基於SOD1*G93A轉基因小鼠實驗結果無法實現臨床轉化的真正原因極大可能(néng)源於其實驗設計的不合理。這(zhè)些實驗因為沒有排除分組時的係統誤差而導致了假陽(yáng)性結果。這個研究也(yě)暴露了當下(xià)使用實驗動(dòng)物開展研究(jiū)的諸多問題,如盲目地追求減少使用動物的數量;對所用動物遺傳、微生物和繁殖(zhí)等特性不了解;實驗過程中對(duì)動物關注不夠,不清楚動物(wù)發病或死亡的(de)真正原因等。這些問題不僅僅需要引起實驗動物從業人員的注(zhù)意(yì),科研人員同(tóng)樣(yàng)需要給予(yǔ)關注。因為實驗設計(jì)不嚴謹導致的(de)假陽性結果(guǒ)不僅是人力(lì)、物力和財力的巨大浪費(fèi),也嚴重有違動(dòng)物實驗倫理福利,這樣的實驗不會帶來科學進步,且浪費了大量實驗(yàn)動物的生命(mìng)。比如在ALS-TDI開展的無法重複(fù)出已發表結果的實驗中(zhōng),那些已經發表的工作累計使用小鼠的數量就超(chāo)過(guò)了18000隻。此外,在動物實驗倫理申請時常用替代、優化和減少(俗稱3R原則(zé))原則來指導倫理審查工作,有(yǒu)時為了滿足(zú)3R原則中的(de)“減少”原則,加上開展實驗成本的(de)考(kǎo)慮,往往選擇使用(yòng)最少的動物數量(比如多為每組6隻),但從ALS-TDI的這個研(yán)究看,樣本量過小,會導致係統誤差加大,因此極大可(kě)能(néng)出(chū)現假陽性結果。這個時候(hòu)大家或許忘了3R原則使用的大(dà)前提是要能夠實現擬開展實驗的科學目標(biāo),如果單(dān)純為了“減少”而使用更少的實驗動物(wù)導致科學目標無法實(shí)現,那(nà)不是減少(shǎo),而是對(duì)動物生命的漠視。
參考文獻(xiàn):
1.Rosen DR, Siddique T, Patterson D, Figlewicz DA, Sapp P, Hentati A, Donaldson D, Goto J, O'Regan JP, Deng HX, et al.: Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature 1993, 362:59-62.
2.Tu PH, Raju P, Robinson KA, Gurney ME, Trojanowski JQ, Lee VM: Transgenic mice carrying a human mutant superoxide dismutase transgene develop neuronal cytoskeletal pathology resembling human amyotrophic lateral sclerosis lesions. Proc Natl Acad Sci U S A 1996, 93:3155-3160.
3.Scott S, Kranz JE, Cole J, Lincecum JM, Thompson K, Kelly N, Bostrom A, Theodoss J, Al-Nakhala BM, Vieira FG, et al: Design, power, and interpretation of studies in the standard murine model of ALS. Amyotroph Lateral Scler 2008, 9:4-15.
4.Fornai F, Longone P, Cafaro L, Kastsiuchenka O, Ferrucci M, Manca ML, Lazzeri G, Spalloni A, Bellio N, Lenzi P, et al: Lithium delays progression of amyotrophic lateral sclerosis. Proc Natl Acad Sci U S A 2008, 105:2052-2057.
5.Kola I, Landis J: Can the pharmaceutical industry reduce attrition rates? Nat Rev Drug Discov 2004, 3:711-715.
6.Hay M, Thomas DW, Craighead JL, Economides C, Rosenthal J: Clinical development success rates for investigational drugs. Nat Biotechnol 2014, 32:40-51.


